奥密克戎出现新亚变体BA.2.75.2,让科学家们担忧!
概要
SARS-CoV-2的Omicron变体的持续进化继续产生新亚变体,并有额外的突变。这些新出现的亚变体之一,称为BA.2.75,已经在世界一些地区迅速传播,具体来说,BA.2.75在印度的出现频率越来越高,2022年7月在全球超过15个国家检测到了BA.2.75,如智利、英国、新加坡、西班牙、德国、韩国、澳大利亚和美国等国家。但尚未超过目前占主导地位的BA.5变体。
与Omicron BA.2亚变体相比,BA.2.75在其Spike蛋白中含有九个额外的突变(K147E, W152R, F157L, I210V, G257S, G339H, G446S, N460K, R493Q)。尽管研究已经表明,与BA.5相比,BA.2.75对某些类别的抗体仍然敏感,但似乎这一变体仍很可能产生能够逃避免疫系统的亚变体。
此外,瑞典、南非、瑞士和英国的研究人员在2022年9月16日发表在bioRxiv平台上的一篇文章中,展示了针对三个Omicron亚变体:BA.2.75.2、BA.4.6和BA.2.10.4的各种抗体的中和能力数据。所测试的抗体已经上市或正在进行临床开发。结果显示,BA.2.75.2和BA.4.6亚变体完全不受西加维单抗和Evusheld组合(单克隆抗体tixagevimab和西加维单抗的组合)中和作用的影响,而BA.2.10.4对西加维单抗保留了一些敏感性。索特罗维单抗对BA.5、BA.2.75.2和BA.2.10.4的疗效很低。
同时,BA.2.75.2亚变体具有显著的逃避抗体中和作用能力。它对人群中的血清抗体的抗性比观察到的对BA.5的抗性高五倍,使BA.2.75.2成为迄今为止最具抗性的Omicron亚变体。鉴于所有这些数据,研究人员得出结论,Omicron亚变体BA.2.75.2拥有很强的免疫逃避能力,因为它有效地逃避了目前的体液免疫。另一个中国研究小组也提供了数据,显示Omicron BA.2.75.2亚系具有抵抗中和抗体的能力:由北京大学曹友龙领导的研究小组发现,Omicron的持续进化已经产生了许多亚变体,与目前占主导地位的BA.5变体相比,具有生长优势。 这是前所未有的。
事实上,Omicron众多亚变体的出现是因为进化趋同(指导致不同变体获得类似突变的进化过程)。例如,不同的变体在Spike蛋白的相同位置发生突变,特别是在受体结合域(RBD),以及一些热点位置,包括R346、R356、K444、L452、N460K和F486。这些趋同突变可能导致病毒具有很强的逃避康复期Covid-19受试者血浆中抗体作用的能力,包括在感染了当前BA.5变体的疫苗接种者身上产生的抗体。
最后,研究结果表明,只需要在BA.5或BA.2.75中再发生五个突变,所产生的亚变体就能具有完全的免疫逃逸能力,同时保留其与人类细胞上的ACE2受体结合的能力。换句话说,趋同进化可能导致出现新的亚变体,这些亚变体对存在于大多数普通人群的血浆中的抗体作用具有完全的抵抗力,包括那些来自接种过疫苗的个人。
BA.2.75.2, le nouveau sous-variant d’Omicron qui inquiète les scientifiques
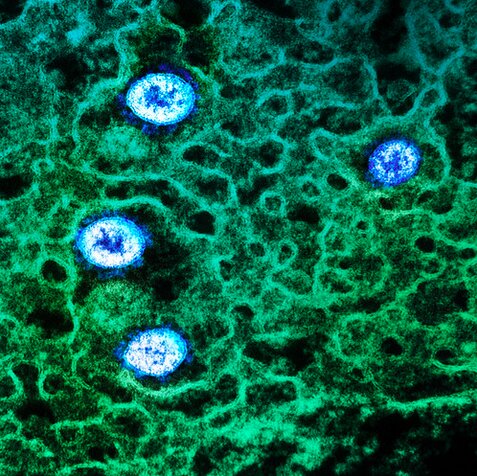
Particules (en bleu) du variant Omicron du SARS-CoV-2. Image colorisée du virus dans une cellule infectée (en vert) obtenue en microscopie à transmission. NIAID Integrated Research Facility (IRF), Fort Detrick, Maryland. © Flickr
L’évolution constante du variant Omicron du SARS-CoV-2 continue de produire de nouveaux sous-variants porteurs de mutations additionnelles. Un de ces sous-variants émergents, dénommé BA.2.75, s’est rapidement diffusé dans certaines parties du monde, mais sans encore surpasser BA.5, le variant actuellement dominant. BA.2.75, dont la fréquence augmente en Inde, a été détecté en juillet 2022 dans plus de quinze pays à travers le monde.
Par rapport au sous-variant BA.2 d’Omicron, BA.2.75 renferme neuf mutations additionnelles dans sa protéine spike (K147E, W152R, F157L, I210V, G257S, G339H, G446S, N460K, R493Q). Même s’il a été montré que BA.2.75 demeure sensible à certaines classes d’anticorps contrairement à BA.5*, il semble néanmoins que ce variant possède encore une importante marge de manœuvre pour générer des sous-variants capables d’échapper au système immunitaire.
De fait, BA.2.75 a encore évolué et a récemment conduit à l’émergence rapide d’un sous-variant, dénommé BA.2.75.2, porteur des mutations R346T, F486S et D1199N. Ce nouveau variant a été détecté en Inde, mais également au Chili, en Angleterre, à Singapour, en Espagne, en Allemagne, en Corée du Sud, en Australie et aux États-Unis.
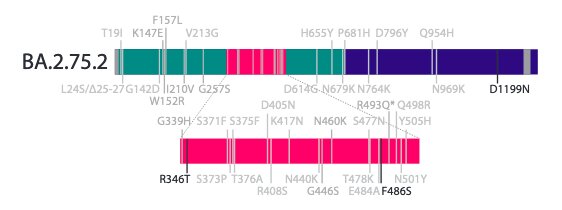
Mutations présentes dans le sous-variant Omicron BA.2.75.2. Sheward DJ, et al. bioRxiv. Sep 16, 2022.
Des mutations différentes, situées à ces mêmes localisations (en l’occurrence en position 346 et 486), avaient déjà été caractérisées dans d’autres variants. Ainsi, la mutation F486V participe à l’évasion immunitaire de BA.5, tandis que la mutation R346K contribue à l’échappement des anticorps dans le précédent variant Mu et était déjà présente dans certains variants BA.1 d’Omicron et largement répandue dans le sous-lignage BA.1.1.
Il apparaît qu’une mutation en position 346, ou en position 486, dans la protéine spike est impliquée dans la capacité du SARS-CoV-2 à échapper aux anticorps et son apparition est favorisée par l’évolution du virus.
Évolution convergente
On parle d’évolution convergente (ou de convergence évolutive) pour désigner le processus évolutif conduisant à l’acquisition de mutations similaires par des variants différents. De fait, un autre variant d’Omicron a récemment acquis une mutation en position 346. C’est le cas de BA.4.6 et de BA.2.10.4. De même, plusieurs sous-lignages, porteurs d’une mutation en position 486, ont récemment émergé. C’est notamment le cas de BA.2.10.4 porteur de la mutation F486P.
Des chercheurs suédois, sud-africains, suisses et britanniques rapportent, dans un article diffusé le 16 septembre 2022 sous forme de preprint sur la plateforme de prépublication bioRxiv, des données sur la capacité de neutralisation de divers anticorps vis-à-vis de trois sous-variants d’Omicron : BA.2.75.2, BA.4.6 et BA.2.10.4. Les anticorps ayant été testés sont déjà commercialisés ou en développement clinique. D’autres anticorps provenaient du sérum de 18 sujets sains, en l’occurrence de personnes ayant très récemment donné leur sang à Stockholm (entre le 29 août et le 4 septembre 2022).
Les résultats montrent que les sous-variants BA.2.75.2 et BA.4.6 échappent totalement à l’action neutralisante des anticorps cilgavimab et de l’association Evusheld (combinaison des anticorps monoclonaux tixagévimab et cilgavimab), alors que BA.2.10.4 conserve une certaine sensibilité vis-à-vis du cilgavimab. L’anticorps sotrovimab possède une faible efficacité contre BA.5, BA.2.75.2 et BA.2.10.4. Seul l’anticorps bebtelovimab reste capable de neutraliser les trois sous-variants testés, soulignent Daniel Sheward, Ben Murrell (Institut Karolinska, Stockholm), Thomas Peacock (Imperial College London) et leurs collègues.
Il s’avère par ailleurs que les sous-variants BA.4.6 et BA.2.10.4 sont modérément plus résistants que l’actuel variant dominant BA.5 vis-à-vis des anticorps présents dans le plasma de personnes récemment prélevées.
BA.2.75.2, sous-variant d’Omicron le plus résistant à ce jour
Concernant le sous-variant BA.2.75.2, celui-ci possède une capacité importante d’échapper à l’action neutralisante des anticorps. Sa résistance aux anticorps sériques présents dans la population est en effet cinq fois supérieure à celle observée contre BA.5, ce qui fait de BA.2.75.2 le sous-variant d’Omicron le plus résistant à ce jour.
Au vu de l’ensemble de ces données, les chercheurs en concluent que le sous-variant d’Omicron BA.2.75.2 possède « une profonde capacité d’évasion immunitaire » dans la mesure où les résultats suggèrent qu’« il échappe efficacement à l’actuelle immunité humorale », c’est-à-dire à l’action des anticorps aujourd’hui rencontrés en population générale.
Une autre équipe, composée de chercheurs chinois, apporte également des données montrant que le sous-lignage d’Omicron BA.2.75.2 possède une capacité étendue de résistance aux anticorps neutralisants. Leurs résultats ont également été communiqués le 6 septembre sur le site de prépublication bioRxiv.
L’équipe dirigée par Youlong Cao de l’université de Pékin constate que l’évolution continue d’Omicron a généré de nombreux sous-variants présentant un avantage de croissance par rapport à l’actuel variant dominant BA.5. Cette situation est sans précédent.
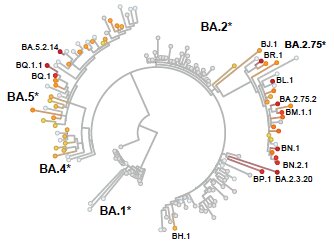
Analyse phylogénétique montrant l’émergence de nombreux sous-variants d’Omicron, dont certains sont porteurs de mutations responsables d’échappement immunitaire et dont l’apparition est sous-tendue par une évolution convergente. Cao Y, et al. bioRxiv. Sep 16, 2022.
L’évolution convergente à l’origine d’une plus grande capacité d’échappement immunitaire
Même si des mutations différentes émergent rapidement et simultanément, générant de nombreux sous-variants, il s’avère que certaines mutations sont communes à certains d’entre eux. Ce phénomène est sous-tendu par une convergence évolutive, comme indiqué plus haut.
On observe ainsi l’apparition dans différents variants de mutations situées à des emplacements identiques dans la protéine spike, plus précisément dans le domaine de liaison au récepteur (receptor-binding domain ou RBD), dont on rappelle qu’il s’agit de la région de la protéine spike en contact avec le récepteur ACE2, porte d’entrée du virus dans les cellules. Ces mutations se produisent aux mêmes positions (hotspots). Il s’agit notamment des mutations R346, R356, K444, L452, N460K et F486.
Les chercheurs chinois rapportent que ces mutations convergentes peuvent être responsables d’une « impressionnante » capacité du virus à échapper à l’action des anticorps présents dans le plasma de sujets Covid-19 convalescents, notamment des anticorps développés chez des personnes vaccinées ayant développé une infection par l’actuel variant BA.5. Ces mêmes mutations sont également responsables d’une résistance aux anticorps monoclonaux disponibles, notamment l’association Evushed (AstraZeneca) et au bebtelovimab (Lilly).
Il s’avère que le sous-variant d’Omicron BA.2.75.2 ayant récemment émergé est la souche dotée de la plus grande capacité d’échappement immunitaire.
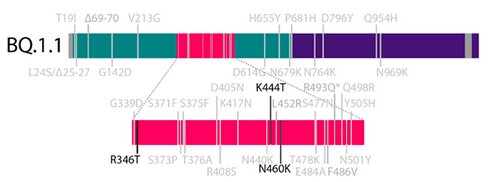
Mutations présentes dans le sous-variant Omicron BQ.1.1. Sheward DJ, et al. bioRxiv. Sep 16, 2022.
Un autre variant, BQ.1.1, porteur de trois mutations supplémentaires par rapport à BA.5 (R346T, K444T, N460K), pourrait également s’avérer préoccupant**.
Les résultats présentés par l’équipe chinoise suggèrent que c’est l’empreinte laissée par une infection antérieure à un variant qui induit l’évolution convergente au niveau du RBD. On sait que cette empreinte comporte un désavantage : elle ne confère pas, ou peu, de réponse protectrice contre l’actuel variant infectant. Autrement dit, une infection antérieure produit une « empreinte antigénique » qui s’avère délétère pour contrer un variant ultérieur. Le système immunitaire, qui garde en mémoire l’empreinte antigénique de l’ancien virus agresseur, n’est pas en mesure de faire face à de nouvelles cibles présentes chez le nouvel attaquant.
Également appelé « péché antigénique originel », le phénomène d’empreinte génétique a été observé lors d’infections par BA.2 et BA.5 (breakthrough infection) chez des sujets vaccinés. C’est ainsi qu’une infection à BA.2 ou BA.5 après vaccination provoque principalement la production de cellules B mémoire identiques à celles induites par le vaccin, mais ne génère que rarement l’apparition de cellules B spécifiques de BA.2 ou BA.5. Cette empreinte antigénique concourt à réduire la capacité du système immunitaire à reconnaître de nouvelles cibles virales antigéniques (épitopes), ce dernier ne produisant des anticorps que faiblement ou pas du tout neutralisants. L’empreinte antigénique a ainsi pour conséquence une réduction de la diversité des anticorps produits en cas de breakthrough infection.
Les résultats présentés suggèrent que l’empreinte antigénique agit comme une force motrice de l’évolution convergente au niveau du RBD. Celle-ci se manifeste concrètement par l’émergence de mutations préférentiellement concentrées en un nombre limité de localisations privilégiées, ces nouvelles mutations contribuant à rogner un peu plus l’efficacité de la réponse en anticorps.
L’évolution convergente pourrait éventuellement abolir la capacité de neutralisation des anticorps
Quel pourrait être le résultat final de la convergence évolutive en termes d’échappement immunitaire ? Pour répondre à cette question, les chercheurs ont construit des pseudovirus, des virus différents du SARS-CoV-2 mais dont ils miment les propriétés en portant à leur surface la protéine spike de certains variants. Des pseudovirus ont ainsi été construits de telle façon à ce qu’ils renferment à leur surface des mutations additionnelles convergentes, ajoutées une à une. Le mutant final contenait 11 mutations additionnelles par rapport à BA.5** et 9 par rapport à BA.2.75.
Comme l’on pouvait s’y attendre, ces pseudovirus mutants se sont révélés résistants vis-à-vis de la majorité des anticorps aujourd’hui disponibles. Par ailleurs, même si ces mutants étaient moins capables que les variants BA.2.75 et BA.5 de se fixer au récepteur humain ACE2, ils pouvaient quand même le faire et même plus fortement que ne l’était la souche ancestrale (caractérisée par la présence de la mutation D614G).
Il a en particulier été montré que ces pseudovirus peuvent largement échapper à l’action des anticorps contenus dans le plasma de personnes vaccinées et de patients Covid-19 convalescents après une breakthrough infection par le variant BA.1 ou BA.2, voire par BA.5. Une telle éventualité mettrait à mal l’immunité acquise par la vaccination ou l’infection.
Enfin, la présence d’un répertoire moins diversifié de la réponse en anticorps pourrait poser un grand défi en matière de protection vaccinale ou d’efficacité des anticorps disponibles. Selon les auteurs, le résultat final de l’évolution convergente pourrait même être encore pire si le nombre limité d’anticorps produits immédiatement après l’infection était incapable de contrer une plus grande pathogénicité du variant en question.
Les résultats obtenus par l’équipe chinoise montrent qu’il ne suffirait que de cinq mutations supplémentaires dans BA.5 ou BA.2.75 pour que les sous-variants ainsi générés soient dotés d’une capacité totale d’échappement immunitaire, tout en gardant leur capacité de liaison au récepteur ACE2 présent sur les cellules humaines. En d’autres termes, l’évolution convergente pourrait aboutir à l’émergence de nouveaux sous-variants complètement résistants à l’action des anticorps présents dans la plupart des plasmas de la population générale, notamment ceux provenant de personnes vaccinées ayant développé une infection par l’actuel variant BA.5 (breakthrough infection).
Selon les chercheurs chinois, l’immunité générale acquise suite à une infection naturelle n’est sans doute pas suffisante pour assurer une protection vis-à-vis de variants porteurs de mutations supplémentaires qui apparaîtraient sous l’influence de la convergence évolutive. « Ces résultats suggèrent que l’immunité de groupe dérivant d’une infection naturelle pourrait difficilement interrompre l’évolution au niveau du RBD et que des rappels vaccinaux basés sur BA.5 peuvent ne pas induire une protection suffisamment large », résument les auteurs.
Et les chercheurs de conclure que le développement de nouveaux vaccins anti-SARS-CoV-2 et d’anticorps monoclonaux à large spectre devrait être « une haute priorité ». Pour ce faire, ils estiment que la connaissance préalable des mutations potentiellement les plus problématiques pourrait servir à créer de pseudovirus porteurs de certaines mutations convergentes pour tester, à l’avance, l’efficacité de candidats vaccins et anticorps monoclonaux prototypes.
Source :
Le Monde
Publié le 19 SEPTEMBRE 2022
声明:本站文章版权归原作者及原出处所有。本文章系本站编辑转载,文章内容为原作者个人观点,登载该文章的目的是为了学习交流和研究,并不代表本站赞同其观点和对其真实性负责,本站只提供参考并不构成任何投资及应用建议。
本站是一个学习交流和研究的平台,网站上部分文章为引用或转载,并不用于任何商业目的。我们已经尽可能的对作者和来源进行了告知,但是能力有限或疏忽,造成漏登或其他问题,请及时联系我们,我们将根据著作权人的要求,立即更正或删除有关内容。本站拥有对本声明的最终解释权。








